|
胰島素抗阻 |
|||||||||||||||||||||||||||||
【前言】
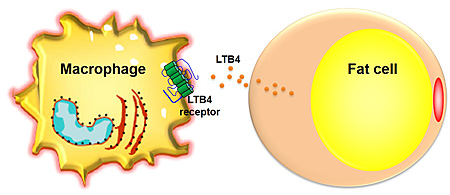
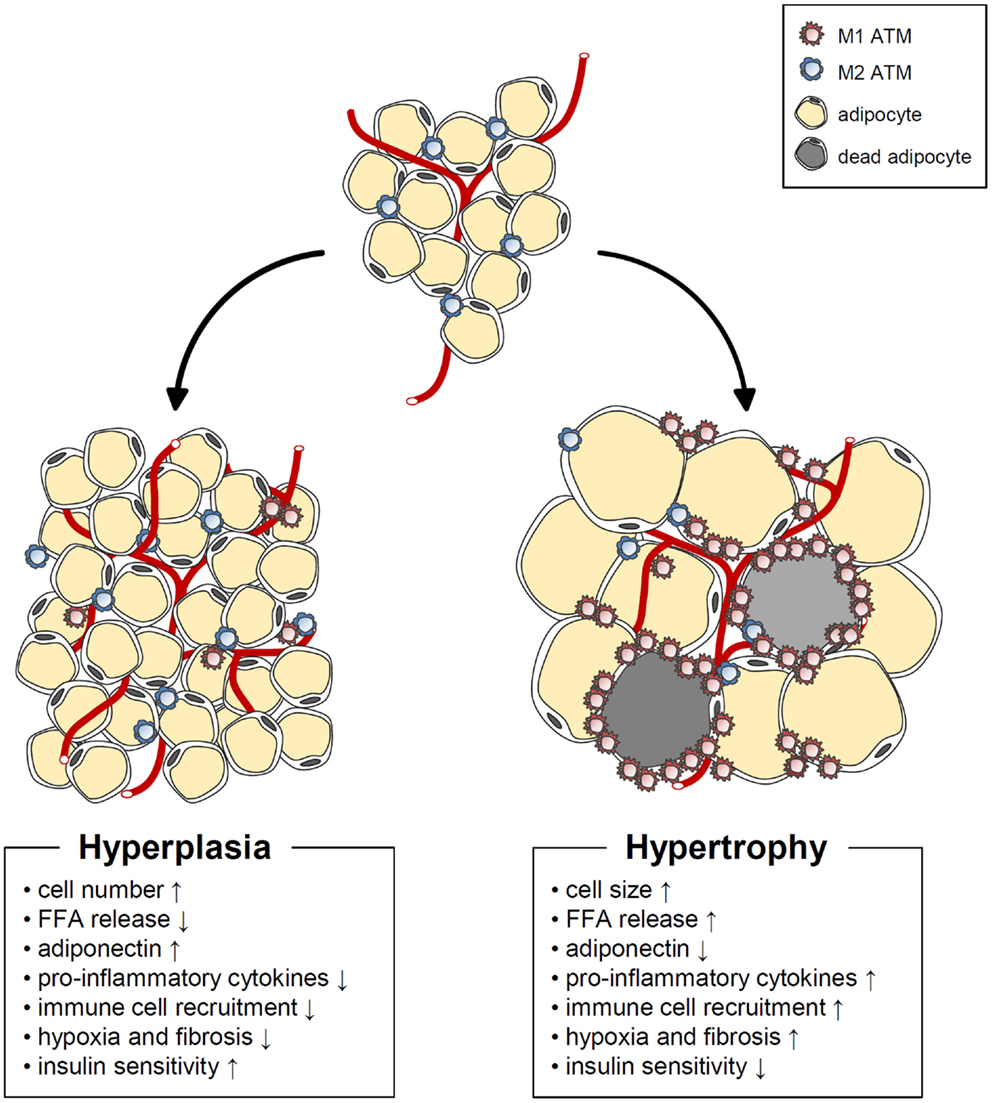
【胰島素抗阻的形成】
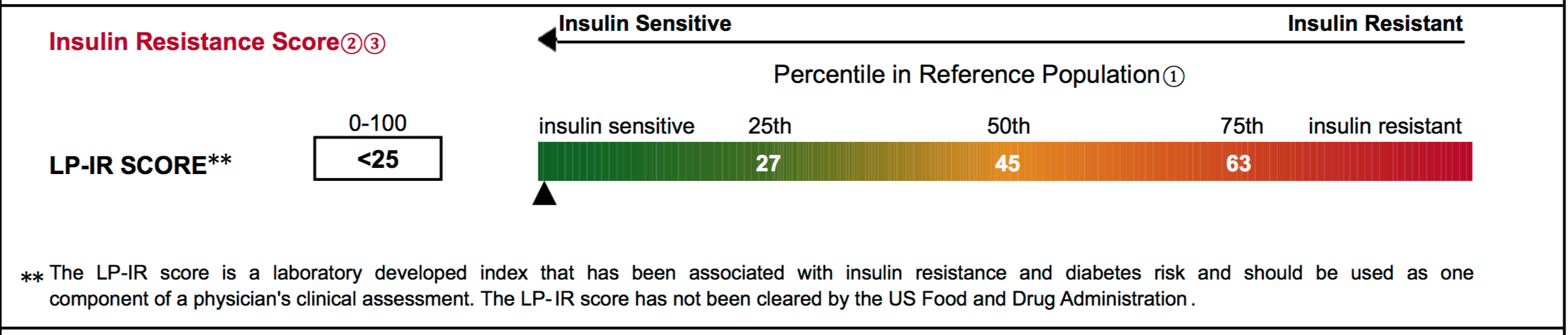
【胰島素阻抗的指標】
檢驗數據:(與代謝症候群的數據相同)
【胰島素阻抗的相關疾病】
【會增加胰島素抗阻的因素】
【改善胰島素抗阻的方法】--以下項目依序功效遞增。斷食的功效最大!(https://www.youtube.com/watch?v=TOTZDjAyar0&t=1174s)
【改善胰島素抗阻的藥物】
【胰島素抗阻因組織而異】
【假性胰島素正常】
【慣性低胰島素】
【生理性胰島素阻抗】
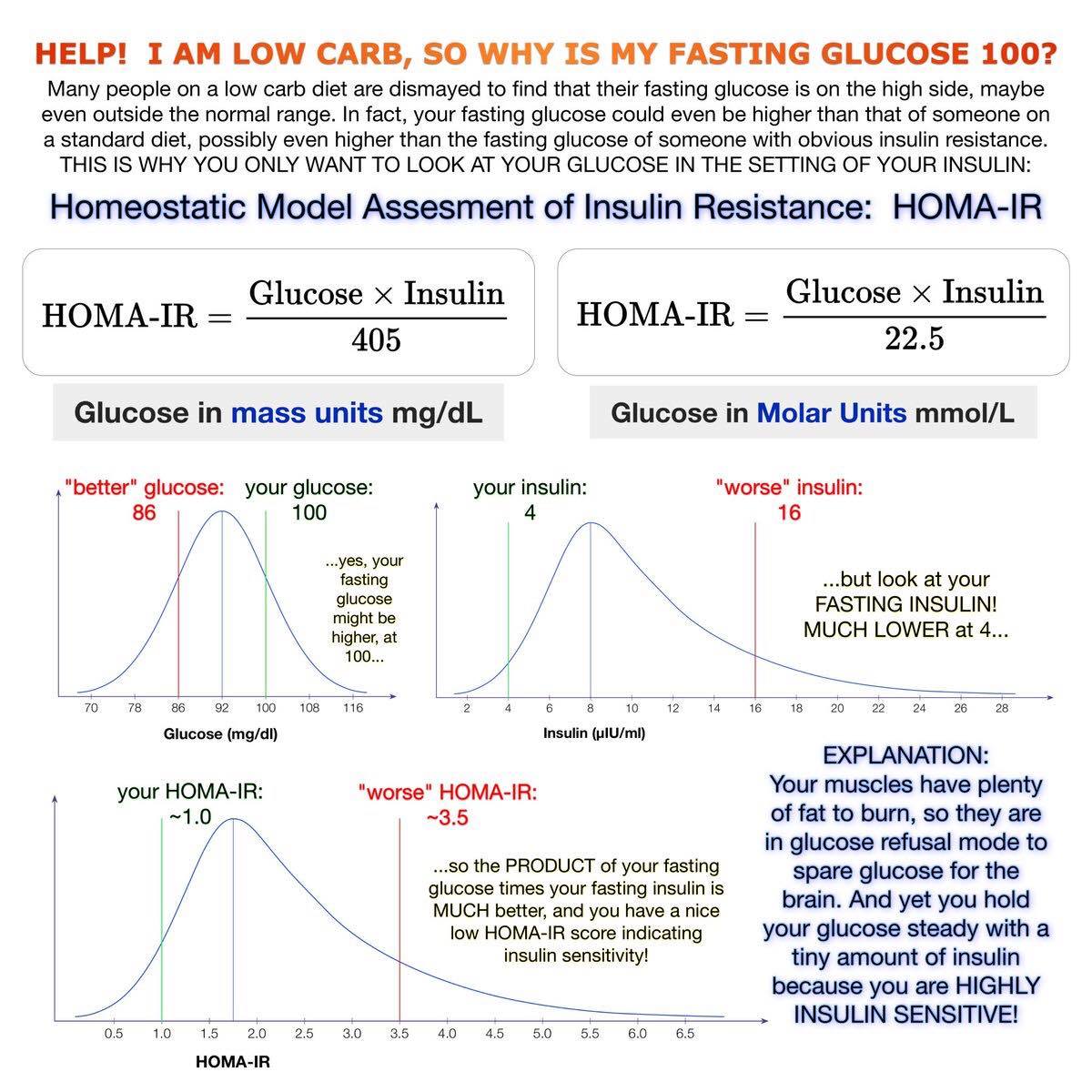
【低醣飲食後的空腹血糖上升】
【Ted Naiman談胰島素抗阻】
【Peter Attia談胰島素抗阻】
|